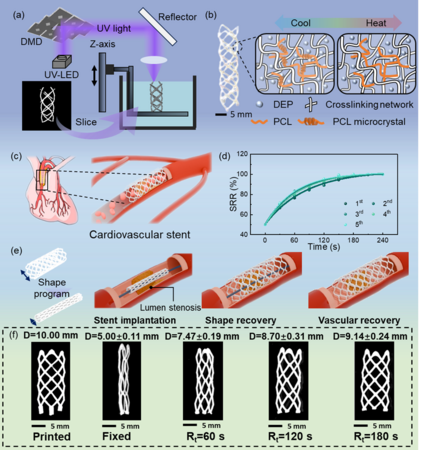
Nanoscope、遺伝性網膜疾患を対象に厚生労働省の先駆け審査指定および希少疾病用医薬品指定を取得:網膜遺伝子治療で初
・MCO-010が厚生労働省より先駆け審査(先駆的再生医療等製品)および希少疾病用医薬品に指定され、重篤な遺伝性網膜疾患患者に対する承認審査の迅速化が可能に
・FDAによる複数の迅速化プログラムおよびEMAによる5件の希少疾病用医薬品指定を含む、世界的な規制対応の進展をさらに強化
・FDA、EMA、PMDAがブランド名「MOGENRY™」を条件付きで承認
・世界規模での上市前準備を強化し、オプトジェネティクス治療におけるリーダーシップを拡大
ダラス、2026年1月22日 /PRNewswire/ — 網膜変性による視力低下に対し、疾患の種類を問わない治療法を開発するNanoscope Therapeutics, Inc.は本日、遺伝性網膜ジストロフィ(IRD)による重度の視力低下患者を対象とした主力のオプトジェネティクス治療「MCO-010」が、厚生労働省から先駆け審査(先駆的再生医療等製品)および希少疾病用医薬品の両方の指定を受けたと発表しました。日本では約5万人の患者がIRDの影響を受けているとされています。
先駆け審査指定制度は、深刻なアンメットメディカルニーズに対応する画期的な治療を対象とした、日本の代表的な迅速審査制度です。本指定を受けると、医薬品医療機器総合機構(PMDA)との連携を通じて規制当局との優先的な相談や審査が可能となり、多くの場合、目標審査期間は6カ月に設定されます。また、承認後のプレミアム価格設定(薬価の加算)がサポートされる可能性があります。今回の決定は、希少疾病用医薬品指定と相まって、日本におけるMCO-010の明確な規制上の道筋を確立するものであり、網膜遺伝子治療として初めての先駆け審査指定となります。
Nanoscope Therapeuticsの社長兼最高科学責任者であるSamarendra Mohanty博士は、「これらの指定は、Nanoscopeおよび遺伝性網膜疾患を患う患者の皆様にとって重要な節目となります」と述べました。「先駆け審査指定を受けたことは、MCO-010の新規性と、承認された治療法が存在しない重度の視力低下に対処する可能性を示しています。欧米での進展も含めて、私たちはオプトジェネティクスによる網膜遺伝子治療において、世界市場を見据えた包括的な規制戦略を推進しています。」
今回の厚生労働省の決定は、主要市場における強固な規制上の進展をさらに後押しするものです。これには、欧州医薬品庁(EMA)による5件の希少疾病用医薬品指定や、米国食品医薬品局(FDA)による網膜適応症に関する複数の迅速化プログラム承認が含まれています。さらに、Nanoscopeが米国で網膜色素変性症に対する生物製剤承認申請(BLA)を進めている中、FDA、EMA、PMDAはブランド名「MOGENRY™」を条件付きで承認しました。
日本、米国、欧州で規制上の道筋が整ったことで、MCO-010は世界で開発されている最先端のオプトジェネティクスプラットフォーム治療としての地位を確立しました。
お問い合わせ先:
Nanoscope Therapeutics, Inc.
電話:(817) 857-1186
メール:PR@nanostherapeutics.com
ロゴ – https://mma.prnasia.com/media2/2718911/NSCOPE_nu_Horizontal_2Color_1200px_Logo.jpg?p=medium600
(日本語リリース:クライアント提供)
PR Newswire Asia Ltd.
PR Newswire
1954年に設立された世界初の米国広報通信社です。配信ネットワークで全世界をカバーしています。Cision Ltd.の子会社として、Cisionクラウドベースコミュニケーション製品、世界最大のマルチチャネル、多文化コンテンツ普及ネットワークと包括的なワークフローツールおよびプラットフォームを組み合わせることで、様々な組織のストーリーを支えています。www.prnasia.com