ヌクレオシド類似体アロブジンに対する細胞抵抗 に必要な新規機構の解明
〜がん治療応用への展開に期待〜
概要
ヌクレオシド類似体は1980年代からHIVなどのウィルス感染症の治療に使用されてきた。アロブジンはフッ素を構造中に持つチミジン類似体の一つであり、かつてHIV治療薬としての治験が進められていたが、その細胞毒性の高さから2相の臨床試験で中止されている。現在、PET検査にその18F標識化合物がトレーサーとして使用されている。この薬品は、複製中にウイルスゲノムに取り込まれて、その複製反応を停止させることでウイルスの増殖を抑えると考えられている。しかし、宿主となるヒト細胞がどのような機構でアロブジンの毒性に抵抗するのか不明のままであった。今回、東京都立大学大学院理学研究科化学専攻の廣田耕志教授らの研究グループは、FEN1*1というDNA複製に寄与するヌクレアーゼが複製中に取り込まれたアロブジンを除去して細胞毒性を低減させる働きを持つことを明らかにした。さらに、FEN1の欠損によりゲノムに蓄積したアロブジンが53BP1*2と呼ばれるDNA修復因子の異常集積を引き起こし、これが原因となってDNAを損傷させていることを明らかにした。この発見は、新たなメカニズムに基づいた抗がん剤開発などへの応用研究に結びつくことが期待される。
発見の背景
ヌクレオシド類似体は、DNAの材料となるヌクレオシドに構造がよく似た化学物質の総称であり、1980年代からHIVなどのウイルス感染症の治療に使用されてきた実績がある。最近では、白血病などのがんの治療にも使用されている。この化学物質は、DNAの材料によく似ているゆえに、DNAの複製(コピーを作る反応)中に新規に合成されるゲノムDNAに取り込まれて、複製反応を阻害する。このため、複製の頻度が高く、反応の正確性の低い、ウイルスやがん細胞の複製反応をより強く抑制するため、これらの治療に使用されている。一方、健康なヒト細胞がどのようにして取り込んだヌクレオシド類似体の毒性を低下させているのか、ほとんど理解されていなかった。
廣田耕志教授の研究室では、さまざまなヌクレオシド類似体の細胞毒性を防ぐための分子機構を包括的に調査・理解するプロジェクトを東京都立大学 高度研究(R3-2)の支援のもとで推進している。これまでに調査したさまざまなヌクレオシド類似体が化学物質ごとに全く違う細胞毒性スペクトラムを示し、薬品ごとにその毒性低下に必要なDNA修復因子が異なることがわかっており、このプロジェクトではがんに見つかるDNA修復因子の変異を「狙い撃ち」にした次世代の治療応用へ展開させることを目標としている。今回、廣田耕志教授は、ホセンMDバイジッド氏(東京都立大学理学研究科博士後期課程3年、都市外交人材育成基金奨学生(現 東京グローバルパートナー奨学金プログラム))、川澄遼太郎助教(東京都立大学理学研究科)とともに、ヌクレオシド類似体のひとつであるアロブジンの細胞毒性に関する調査を実施してその毒性を防ぐ分子機構を明らかにした。
発見の詳細
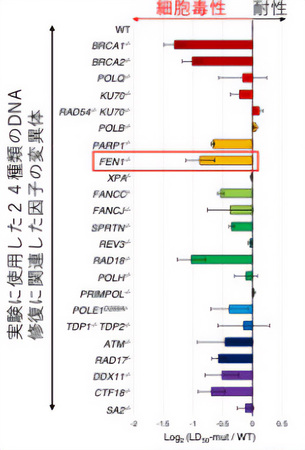
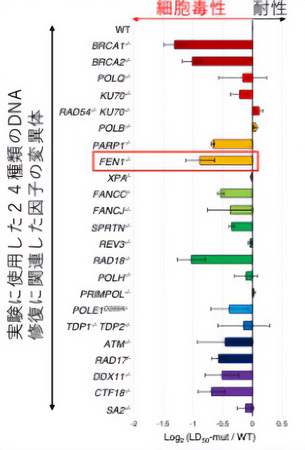
今回、廣田耕志教授の研究チームは、24種類のDNA修復に関与する遺伝子の変異体を用いて、アロブジンの毒性(細胞増殖をどのくらい強く抑制するのか)を調査した。その結果、FEN1*1というDNAの複製反応において機能するヌクレアーゼ酵素(DNAを切断する酵素)をコードするFEN1遺伝子の変異細胞がアロブジンに対し高い細胞毒性を示すことを突き止めた(図1)。さらに、DNA複製の速度を測定すると、FEN1遺伝子を欠損した細胞ではアロブジン処理後の複製速度が遅くなっていることがわかった(図2)。
アロブジンの細胞毒性を防ぐために寄与するDNA修復因子の探索
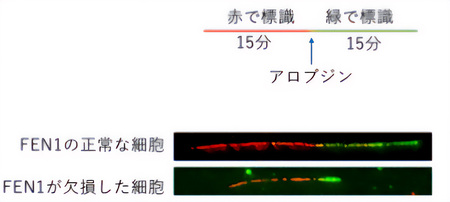 図2
図2
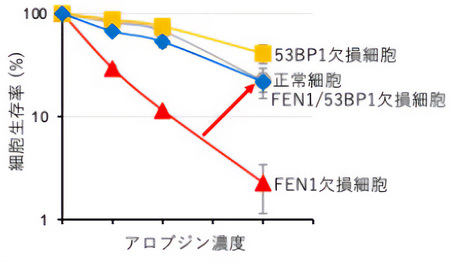
興味深いことに、FEN1欠損細胞が示すアロブジンへの超感受性は、53BP1と呼ばれるDNA修復酵素をコードする遺伝子の同時欠損でほとんど正常細胞レベルまで回復することがわかった(図3)。このことは、FEN1が存在しないと53BP1がアロブジンによって有毒な作用を示すことを示している。さらに、複製中にFEN1欠損細胞ではアロブジン処理により53BP1のゲノムへの異常な集積が起こり、これがDNA損傷につながっていることが明らかとなった。
FEN1と53BP1のアロブジンへの細胞耐性における関係性
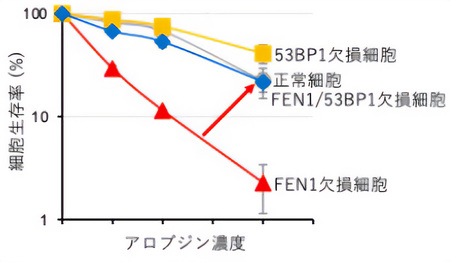 図3
図3
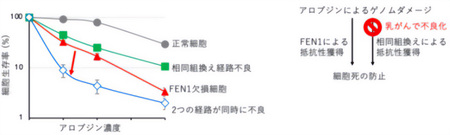
2024年の同研究チームの先行研究でアロブジンの毒性への細胞抵抗性には、BRCA遺伝子*3などが関与することが知られている「相同組換え経路」が寄与することを報告していた(図1の上から2、3番目のバー)。今回、研究チームが発見したFEN1によるアロブジン毒性の防止機構と相同組換え経路の関係性を調査するために、FEN1と相同組換えが同時に不良化した細胞を作製し両経路の関係性を調べると、両経路が同時に欠損した細胞ではどちらか一方の経路が不良化した細胞に比べ大幅にアロブジンへの細胞抵抗性が低下する結果が得られた(図4、左)。この結果から、FEN1は相同組換えとは独立にアロブジンへの細胞毒性の防止に寄与していることがわかった。さらに、ここで発見したFEN1経路不良と相同組換え経路不良の相乗効果(シナジー効果)の知見は、乳がんなどのBRCA遺伝子*3変異を持つがんの治療への応用に貢献できる可能性がある。
FEN1の活性阻害で相同組換え異常を示すがん細胞のアロブジン感受性を著しく上昇させることができる
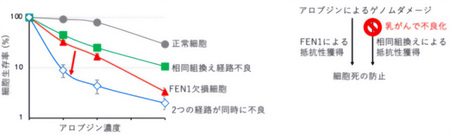 図4
図4
これらの結果から、複製の最前線で新生鎖にアロブジンが取り込まれた際、FEN1がヌクレアーゼ活性により異常なDNAを切除することでアロブジン毒性の低下に寄与していることが明らかとなった。一方で、これがうまく進まずアロブジンがゲノムに残ると、53BP1が異常集積してより深刻なDNA損傷を引き起こすことで細胞死につながっていることが示唆された。この成果は、FEN1遺伝子の変異や発現異常はさまざまながんに見られることから、FEN1遺伝子変異を持つがんの治療に応用されることが期待される。また、今後の医療展開に向け、実際の患者由来のFEN1遺伝子変異を有するがん細胞でのアロブジンとのシナジー効果や、固形腫瘍など異なる性状を持つがんでの効果についてさらに解明する必要性があり、多くの課題が残っている。
意義と波及効果
今回の研究では、アロブジンが誤ってゲノムに取り込まれた際、「FEN1のアロブジン除去」と「53BP1によるアロブジン有毒化」という、ユニークな化学物質の毒性発揮と防止のメカニズムを解明した。この機構は世界で初めて示される機構である。また、本研究では、FEN1活性の変異や発現異常による低下が、アロブジン処理時には細胞の生存においてクリティカルな効果をもつことを示している。この研究成果は、治療効果の予測や新規の抗がん剤開発などへの応用研究に結びつくことが期待されている。
・新規がん治療への波及効果
新規のがん治療への波及効果については、FEN1のヌクレアーゼ活性や核内局在に関わる領域の変異は多くのがん細胞で見つけられている。このようながん細胞では、アロブジン除去機構が不良となっていることが予想されるため、有効なバイオマーカーとなることが期待される。FEN1遺伝子のがん細胞での変異や発現異常について治療前に診断し、もし変異等の異常を同定できたら、従来ウイルス治療やPET診断に使用されていたアロブジン薬が有効であると推定できる。さらなる研究で、FEN1遺伝子vsアロブジンの間のシナジー効果について、患者由来のヒト細胞での研究や、固形腫瘍における効果など今後さらに検討を進め、新しい治療に結びつくことが期待される。
・新規抗がん剤への展開
次に、新規の抗がん剤開発への展開については、上記のように、FEN1のヌクレアーゼ活性機能低下は大幅なアロブジンに対する増感作用が見込まれる。FEN1のヌクレアーゼ活性を標的とした薬品が開発されれば、家族性乳がんなどのBRCA遺伝子変異や相同組換え経路不良を持つがん細胞において、アロブジンに対する感受性を著しく高めることが期待される。これは、より効果的ながんの治療につながる可能性を示唆している(図4、右)。
以上のように今後、本研究成果が新しい医療や医薬品開発などの応用に結びつけられることが期待される。
【用語解説】
*1 FEN1
複製反応は、連続的に複製反応が進むリーディング鎖と、短い断片(岡崎フラグメントと呼ばれる)を繰り返し合成して、連結させることで複製反応が進むラギング鎖で、同時に行われている。ラギング鎖の合成時に、1つ1つの新生鎖末端が少し浮き上がった領域(フラップ構造という)を切断して、効率的な結合を進める酵素がFEN1である。
*2 53BP1
DNAダメージに集積し、細胞分裂の周期を抑えるとともに、修復酵素と相互作用して修復を誘導する因子。放射線などによるDNA損傷誘導に応答し、核内にドット状の焦点を形成する。近年、岡崎フラグメントとの結合が報告され、複製反応へも寄与すると考えられている。
*3 BRCA遺伝子
BRCA1遺伝子とBRCA2遺伝子を指す。どちらの遺伝子も相同組換え反応の推進にとって不可欠な因子をコードしており、その変異により相同組換え経路は不良化すると考えられる。遺伝性乳がん卵巣がん症候群はBRCA1またはBRCA2遺伝子の変異が原因となって引き起こされる。乳がん全体の3−5%、卵巣がん全体の10−15%を占める(日本HBOCコンソーシアムの資料から)。また、この遺伝子の変異により前立腺がんと膵臓がんの発症率も高まる。
【論文情報】
タイトル: The flap endonuclease-1 promotes cellular tolerance to a chain-terminating nucleoside analog, alovudine by counteracting the toxic effect of 53BP1
著者: Md Bayejid Hosen, Ryotaro Kawasumi, and Kouji Hirota
DOI: 10.1093/nar/gkaf617
7月18日付けのNucleic Acids Researchオンライン版で発表
【注意事項】
報道の解禁 日本時間 7月18日 午前9時1分
編集部からのお知らせ
新着情報
あわせて読みたい

自動車リサイクル促進センター