アキレス腱断裂:生理的な腱再生をもたらすシグナルを同定
PI3K-Aktシグナルは腱細胞と腱滑膜細胞の細胞増殖能,細胞遊走能,幹細胞性を制御して生理的腱再生をもたらす
2025年5月 日
国立大学法人東海国立大学機構 岐阜大学
アキレス腱断裂:生理的な腱再生をもたらすシグナルを同定 PI3K-Aktシグナルは腱細胞と腱滑膜細胞の 細胞増殖能、細胞遊走能、幹細胞性を制御して生理的腱再生をもたらす
本研究のポイント
・若齢マウスに備わる生理的腱再生を制御するシグナルとしてPI3K-Aktシグナルを同定しました。
・若齢マウスのアキレス腱損傷モデルにおいて、PI3K-Aktシグナルを抑制すると、再生腱の菲薄化、力学的強度の低下、歩行能力の低下をもたらしました。
・PI3K-Aktシグナルは再生腱の細胞源である腱細胞(Scx+細胞)と腱滑膜細胞(Tppp3+細胞)の細胞増殖能、細胞遊走能、幹細胞性を制御していることを明らかにしました。
研究概要
岐阜大学 整形外科の後藤篤史(現 山内ホスピタル)、河村真吾特任講師、秋山治彦教授らの研究グループは、東京大学 分子病理学分野 山田泰広教授、東京大学医科学研究所 システム疾患モデル研究センター 小沢学准教授、田口純平特任助教、愛媛大学 プロテオサイエンスセンター 今井祐記教授、東京科学大学 システム発生・再生医学分野 淺原弘嗣教授、松島隆英助教、東京科学大学 生体材料工学研究所 岸田晶夫教授、東洋大学 生命科学部生体医工学科 木村剛教授との共同研究で、腱の再生に関わる重要なシグナル伝達経路であるPI3K-Aktシグナルを発見しました。
腱は再生能力が低いため、成人・高齢者の腱損傷後の修復には年単位を要し、健常な状態へ再生することは困難です。一方、小児の腱損傷においては治癒期間も短く、再断裂や癒着をきたしにくいです。本研究では、加齢に伴い変化する腱再生能力を規定する分子制御機構を解析し、PI3K-Aktシグナルを同定しました。PI3K-Aktシグナルは腱再生の細胞源である腱細胞(Scx+細胞)と腱滑膜細胞(Tppp3+細胞)の細胞増殖能、細胞遊走能、幹細胞性を制御していることを明らかにしました。本成果は、治療に難渋する成人・高齢者の腱疾患・外傷に対する新規治療法開発の足掛かりになると期待されます。
本研究成果は、日本時間2025年4月20日にNature Communications誌のオンライン版で発表されました。
研究背景
高齢者やスポーツ人口の増加に伴い、運動器疾患を有する患者は増加しています。なかでも腱疾患(腱損傷や腱炎・腱鞘炎)は運動器疾患の約30%を占めるcommon diseaseです。腱は再生能力が低いという特徴があり、損傷した腱の修復には年単位を要し、生理学的に健常な腱の状態へ再生することは困難と言われています。私たちは、日々の診療において、成人・高齢者の腱損傷と比較して、小児の腱損傷においては治癒期間も短く、再断裂や癒着をきたしにくいことを経験しています。つまり、腱には生来再生能力が備わっているものの、それは加齢に伴い減弱、消失すると考えられます1。
そこで私たちは、加齢に伴い変化する腱再生能力を規定する分子制御機構を解明することで、治療に難渋する成人・高齢者の腱疾患に対して生理的腱再生を誘導する新規治療法開発の足掛かりになると考えました。
研究成果
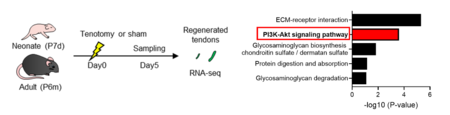
若齢マウス(生後7日齢)と高齢マウス(生後6カ月齢)のアキレス腱損傷モデルを作製し、再生腱のRNAシーケンス、ウエスタンブロット解析を行いました。若齢マウスのアキレス腱再生部位でPI3K-Aktシグナルが特異的に活性化すること同定しました(図1)。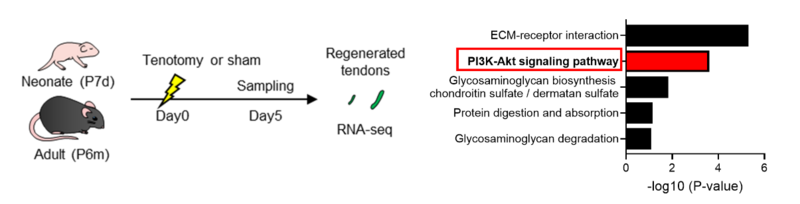
図1.若齢マウスと高齢マウスのアキレス腱損傷後(5日目)のRNAシーケンス解析
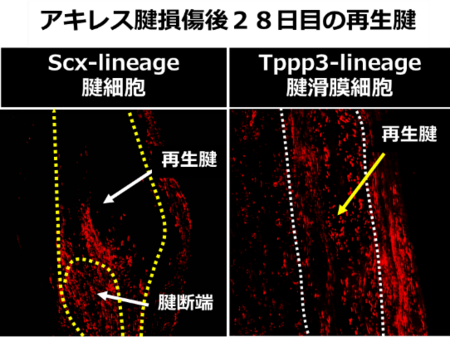
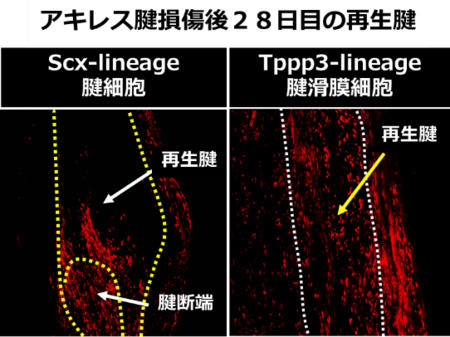
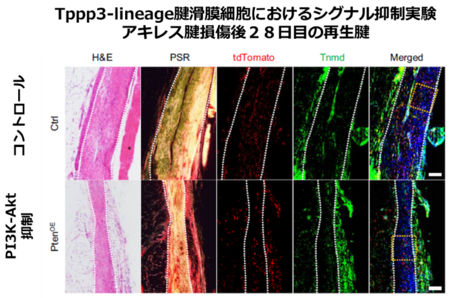
腱細胞特異的遺伝子組み換えマウス(Scx-CreERT2/Rosa26-LSL-tdTomato)、腱滑膜細胞特異的遺伝子改変マウス(Tppp3-CreERT2/Rosa26-LSL-tdTomato)2,3を使用して、若齢マウスのアキレス腱損傷後の再生起源細胞を解析しました。Scx-lineage腱細胞とTppp3-lineage腱滑膜細胞が腱再生に寄与していました。なかでもTppp3-lineage腱滑膜細胞が主要なアキレス腱再生の細胞源でした(図2)。
図2. アキレス腱損傷後28日目の再生腱
赤色がScx-lineage腱細胞:左、Tppp3-lineage腱滑膜細胞:右を示す)
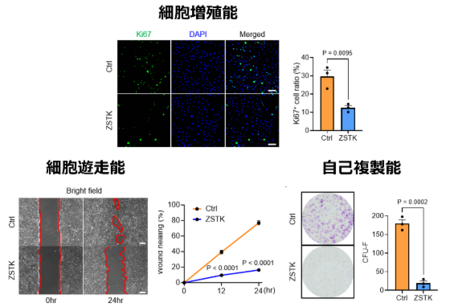
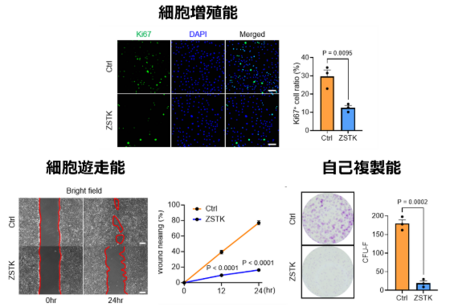
PI3K-Aktシグナルが腱細胞と腱滑膜細胞に与える影響をin vitroで解析しました。ラットアキレス腱由来腱細胞および腱滑膜細胞にPI3K-Aktシグナル阻害剤(ZSTK474)を投与した結果、細胞増殖能、細胞遊走能、自己複製能が低下しました。一方で、成熟腱細胞への分化が促進しました(図3)。
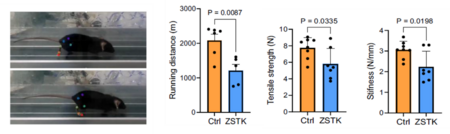
続いて PI3K-Akt シグナルがアキレス腱再生に与える影響を in vivo で解析しました。若齢マウスのアキレス腱断裂モデルに対して ZSTK474 を投与した結果、再生腱の菲薄化と力学的強度の低下および歩行能力の低下が認められました(図4)。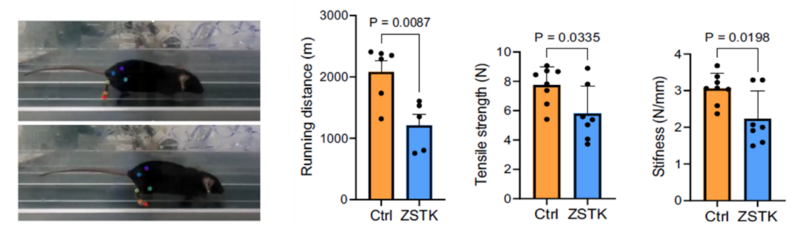
図4. PI3K-Akt阻害剤投与によるマウスの歩行能力とアキレス腱力学強度の変化
さらにアキレス腱再生時に PI3K-Akt シグナルが腱細胞と腱滑膜細胞に与える影響を解析しました。 PI3K-Akt シグナルの負の制御因子である Pten の細胞種特異的過剰発現マウス (Scx-CreERT2/Rosa26-LSL-Pten および Tppp3-CreERT2/Rosa26-LSL-Pten) を使用してアキレス腱再生を解析した結果、 Scx-lineage 腱細胞と Tppp3-lineage 腱滑膜細胞の双方において細胞増殖能および再生腱内への細胞遊走能が低下しました。腱再生の主要な細胞源である Tppp3-lineage 腱滑膜細胞での PI3K-Akt シグナルの抑制によって再生腱の菲薄化が認められました(図 5 )。
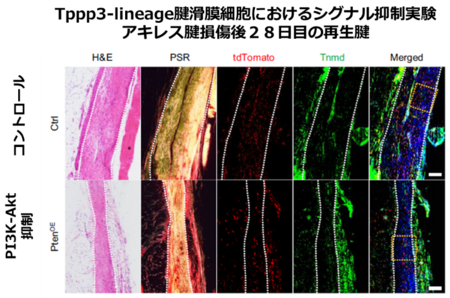
図5. Tppp3-lineage腱滑膜細胞におけるPI3K-Aktシグナル抑制実験(アキレス腱損傷後28日目の再生腱)
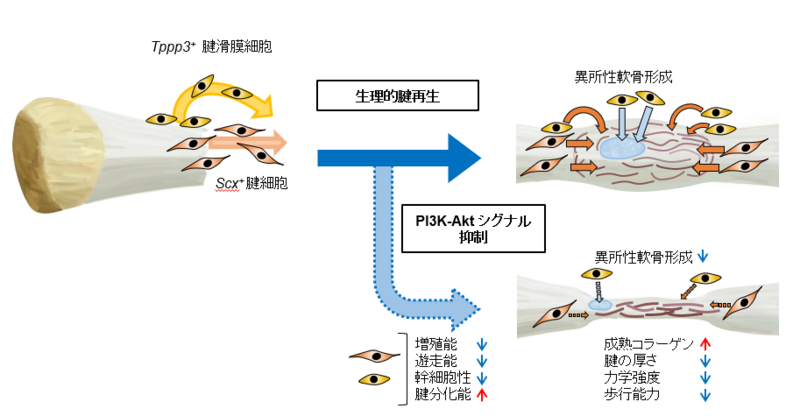
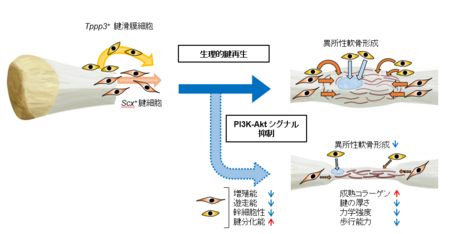
以上の結果より、PI3K-Aktシグナルは腱再生の細胞源である腱細胞(Scx+細胞)と腱滑膜細胞(Tppp3+細胞)の細胞増殖能、細胞遊走能、幹細胞性を制御する重要なシグナル伝達経路であることが明らかとなりました(図6)。
今後の展開
本研究では、若齢マウスにおいて生理的腱再生を制御するPI3K-Aktシグナルを同定しました。今後、高齢マウスにおいてPI3K-Aktシグナル活性化による腱再生促進効果を詳細に検証することで、成人・高齢者の腱再生治療の開発につなげたいと考えています。
用語解説
※1 RNAシーケンス:次世代シーケンサーを使用して遺伝子発現を網羅的に解析する手法。
※2 in vitro:培養器内等の、生体外の環境下で行う実験。
※3 in vivo:生体内で行う実験。
※4 Scx:腱細胞で特異的に発現する遺伝子Scleraxisの略。
※5 Tppp3:遺伝子Tubulin Polymerization Promoting Protein Family member 3の略。腱滑膜細胞マーカーとして使用される。
※6 CreERT2:estrogen受容体とCreの融合タンパク質。内因性のエストロゲンには反応せず、タモキシフェンに反応してCre組み換え反応を誘導可能にしたもの。
※7 Rosa26-LSL-tdTomatoマウス:Rosa26プロモーターの下流にloxP-stop-loxP(LSL)と赤色蛍光タンパクtdTomatoが配置してある。Cre組換え反応によってLSL発現によってstopが外れ、tdTomatoが発現する(赤く光る)仕組み。
※8 Rosa26-LSL-Ptenマウス:Rosa26-LSL-tdTomato マウス同様。Cre組換え反応によってPtenが発現する(PI3K-Aktシグナルが抑制される)仕組み。
参考文献
1. Komura, S. et al. Induced pluripotent stem cell-derived tenocyte-like cells promote the regeneration of injured tendons in mice. Sci. Rep. 10, 3992 (2020).
2. Komura, S. et al. Cell-type dependent enhancer binding of the EWS/ATF1 fusion gene in clear cell sarcomas. Nat. Commun. 10, 3999 (2019).
3. Harvey, T., Flamenco, S. & Fan, C. M. A Tppp3+Pdgfra+ tendon stem cell population contributes to regeneration and reveals a shared role for PDGF signalling in regeneration and fibrosis. Nat. Cell Biol. 21, 1490–1503 (2019).
研究サポート
本研究は以下の支援を受けて実施しました。
・公益社団法人武田科学振興財団 医学系研究助成
・日本学術振興会 科学研究費助成事業 研究活動スタート支援(16H06845)、 若手研究(18K16617) 、
基盤研究(C)(18K09101)、基盤研究(B)(21H03052、23K21465)
・先端モデル動物支援プラットフォーム JSPS科研費 JP18K09101(AdAMS)、JP18K16617(AdAMS)
【論文情報】
雑誌名: Nature Communications
論文タイトル: PI3K-Akt signalling regulates Scx-lineage tenocytes and Tppp3-lineage paratenon sheath cells in neonatal tendon regeneration
著者: Goto A, Komura S*, Kato K, Maki R, Hirakawa A, Aoki H, Tomita H, Taguchi J, Ozawa M, Matsushima T, Kishida A, Kimura T, Asahara H, Imai Y, Yamada Y, Akiyama H.
*Corresponding author
DOI: 10.1038/s41467-025-59010-y