無害な光を用いたイメージングによる細胞内DNA・RNAの同時検出
細胞老化・損傷の超早期発見による疾病予防・治療に向けて
2025年10月27日
NIMS( 国⽴研究開発法⼈物質・材料研究機構 )
国⽴⼤学法⼈東海国⽴⼤学機構 名古屋⼤学
国⽴⼤学法⼈東海国⽴⼤学機構 岐阜⼤学
NIMSは、名古屋大学、岐阜大学、アデレード大学との共同研究により、無害な赤外光~近赤外光を用いて細胞内のDNAとRNAを同時にイメージングする方法を開発しました。本研究により、細胞死の全段階を高精度で検出することが可能になりました。これは、疾患予防のための細胞老化と損傷の早期発見につながります。この研究成果は、10月23日にScience Advances誌にて掲載されました。
研究成果の概要
■従来の課題
細胞老化や細胞死に至る細胞のダメージを早期に発見することは、さまざまな病気の治療戦略開発の鍵となります。そのためには、発症から終末までの細胞の変化を観察する(細胞イメージング)ことが不可欠です。現行手法の多くが、可視光や紫外光などの細胞に有害な光を用いていること、複数の損傷状態を同時に検出する感度や能力に欠けることなどの問題を抱えています。このため、しばしば、疾病の発見が遅れたり、治療後の細胞運命の全体像が不完全になったり、治療効果に誤った結論が導かれたりします。それらの問題を解決するために、細胞に無害な赤外光~近赤外光励起を用いて、細胞状態を完全に把握する汎用的かつ高感度なイメージング方法の開発が望まれています。
■成果のポイント
今回、研究チームは、DNAとRNAに対して異なる結合様式を示す蛍光色素プローブ(N-ヘテロアセン色素)を用いて、細胞に無害な二種類の光を同時に照射し、その蛍光を観測することで細胞内のDNAとRNAの両方を安全かつ同時に可視化することに成功しました。DNAイメージングによる持続的な細胞損傷評価に加えて、RNAイメージングが細胞損傷や細胞老化の初期予測においてより高い感度を提供することを明らかにしました。このDNA・RNAの同時イメージングによって、細胞損傷の初期評価と細胞死の全四段階の高精度検出が可能になりました。これらの知見は、単一細胞の状態遷移を可視化する戦略として、現在利用可能なあらゆるイメージングシステムの限界を超える方法になります。細胞の損傷や老化を超早期に発見することが可能となり、細胞毒性を最小限に抑えたイメージングワークフローを通して、生細胞の検査による疾病の発見やハイスループット創薬スクリーニングへの応用が期待されます。
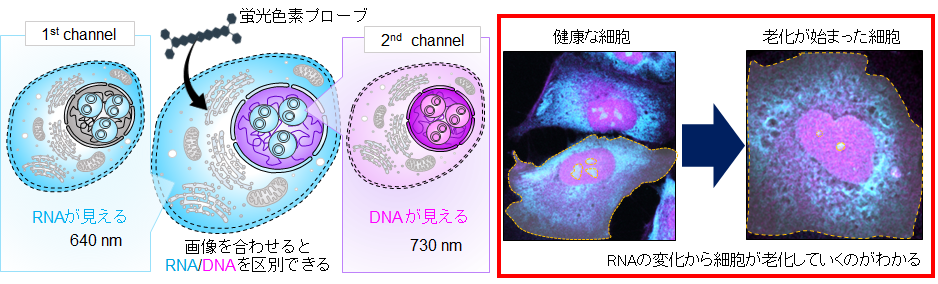
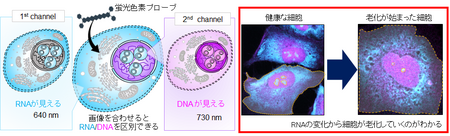
図: 細胞に無害な赤色光~近赤外光を2種類用いて励起することにより細胞内でDNAとRNAを同時に見分ける(左)と細胞が老化していくのがわかる(右)
■将来展望
今後、この手法の実際の生物への応用も検証していきたいと考えています。疾患の早期発見、細胞ストレスのモニタリング、精密医療戦略を可能にする道筋を拓くことを目指しています。“未病(健康な状態と病気の間にある、健康から離れつつある状態)にあることが細胞を見ればわかる”ような技術の開発を目標としています。
■その他
・本研究は、NIMS若手国際研究センターのリナワティ・ストリスノ(ICYS 研究員)、NIMSナノアーキテクトニクス材料研究センターのゲイリー・J・リチャーズ(博士研究員)、松本道生(研究員)、ジョナサン・P・ヒル(グループリーダー)、有賀克彦(特命研究員)、NIMS高分子・バイオ材料研究センターの宇都甲一郎(主幹研究員)、材料創製・評価プラットフォーム バイオ分析ユニットの李香蘭(NIMSエンジニア)、アデレード大学のジャック・D・エヴァンス(研究員)、岐阜大学の多喜正泰(教授)、名古屋大学の山口茂弘(教授)からなる研究チームによって行われました。
・本研究成果は、2025年10月23日にオープンアクセス誌Science Advancesのオンライン版に掲載されました。
研究の背景
細胞老化や細胞死に至る細胞のダメージを早期に発見することは、さまざまな病気の治療戦略開発の鍵となります。そのためには、発症から終末までの細胞の変化を観察する(細胞イメージング)ことが不可欠です。現行手法の多くが、可視光や紫外光などの細胞に有害な光を用いていること、複数の損傷状態を同時に検出する感度や能力に欠けることなどの問題を抱えています。特に、不均一な細胞集団における細胞運命(1)の遷移を正確に決定するには、単一細胞レベルで複数の分子状態を感度高く同時にモニタリングできる細胞イメージングプローブ(2)が必要となります。特に、RNAとDNAを同時に区別して観察してその変化を見ることは、細胞状態を決定するうえで非常に有力な手法となりえます。しかしながら、従来のDNA・RNAイメージング用の色素は通常どちらか一方を標的にしているにすぎません。ごく一部のRNAとDNAを区別できる色素も、紫外光-可視光励起に依存しているので、これらの光に敏感な細胞株や強い自家蛍光(3)を示す細胞株において、不正確な結果をもたらします。そのような難点によって、しばしば、疾病の発見が遅れたり、治療後の細胞運命の全体像が不完全になったり、治療効果に誤った結論が導かれたりします。それらの問題を解決するために、細胞に無害な波長640 nm(ナノメートル、ナノは10憶分の1)以上の光による励起光を用いて、細胞状態を完全に把握する汎用的かつ高感度なイメージング方法の開発が望まれています。例えば、細胞核の形態を観察することは有力な細胞老化現象の評価法ですが、老化初期段階では変化が小さいため、有用性は限定的です。細胞の老化や損傷を早期に見つけ出すためには、イメージングによって、それらを高感度に捉える必要があります。
研究内容と成果
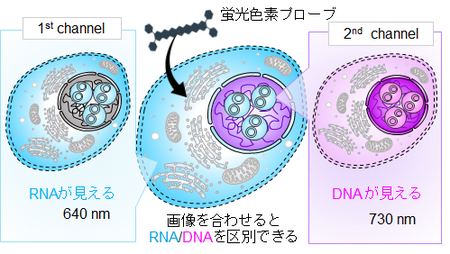
今回、研究チームは、DNAとRNAに異なる結合をする蛍光色素プローブ(4)であるN-ヘテロアセン色素(5)を用いて、赤色・近赤外光同時励起で細胞内のDNAとRNAの両方を安全かつ同時に可視化することに成功しました。この色素は、シミュレーション計算によると、DNAとRNAに対して以下に述べるような異なる結合をすることがわかりました。この色素は、DNA のマイナーグルーブ(二重らせん構造に沿った小さい溝構造)に優先的に挿入されます。一方、RNA とは多様な相互作用をして、水素結合や非特異的静電相互作用によって結合することがわかりました。それにともなって、この色素は、DNA に結合したときと、RNA に結合した際に異なる発光挙動を示すことになります。この色素で処理した固定化細胞のイメージングでは、640 nm励起時と730 nm励起時で異なる染色パターンが観察されました。640 nm励起信号は主にRNA豊富な領域に由来し、730 nm信号は主にDNA豊富な領域に対応しています。この特性により、二重の近赤外励起下でDNAとRNAの両方を安全かつ同時に可視化することができ、単一ステップでRNAとDNAの同時染色が可能になりました(図1)。
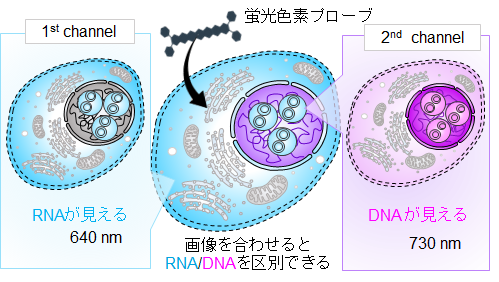 図1 細胞の中で DNA と RNA を同時に見分ける仕組み
図1 細胞の中で DNA と RNA を同時に見分ける仕組み
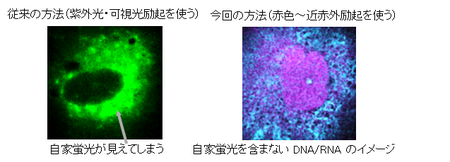
細胞毒性(6)試験により、この色素は低濃度(10 mmol/L以下)では実質的に無毒であることが確認され、この条件を基にさらなる生細胞イメージング実験を実施することができました。通常のイメージング色素に比べて、我々の用いた色素は細胞毒性が約100分の1と低く、24時間までの連続イメージングが可能になります。これによって、細胞の状態の変化を長い時間連続的にモニタリングすることができるようになります。また、紫外光や可視光を用いる従来の方法では、細胞から自然に光が出される自家蛍光が問題になります。それに対して、本方法では、顕微鏡の最大レーザー出力下でも640 nm以上の励起波長で細胞を観察した場合には、自家蛍光はほとんど観察されず、本方法で用いた近赤外励起チャネルが細胞の蛍光強度を正確に定量するのに適していることが確認されました(図2)。
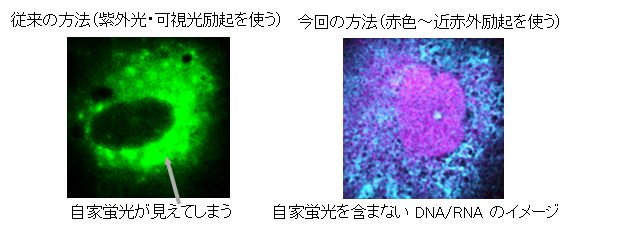 図2 今回の赤色~近赤外光同時励起を用いる手法では、細胞の自家蛍光を含まない正しいイメージを観察することができる。
図2 今回の赤色~近赤外光同時励起を用いる手法では、細胞の自家蛍光を含まない正しいイメージを観察することができる。
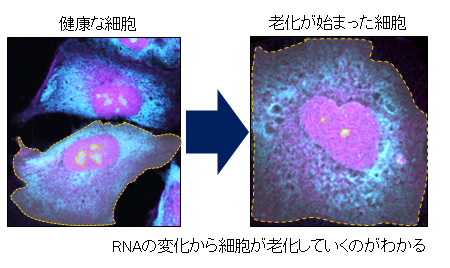
RNAは、その80%以上が細胞質に存在しており、タンパク質合成やストレス応答に関与しています。RNAを選択的にイメージングしてその動向を見ることによって、細胞老化の初期段階における損傷の兆候を、極めて高い感度で検出することができます(図3)。
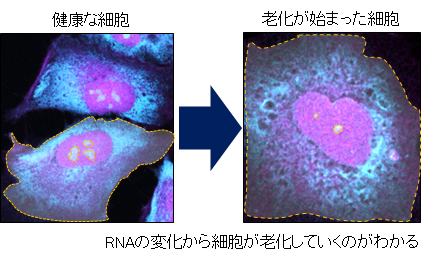 図3 DNAとRNAのイメージ(特に、青い RNA からの信号の減少)から老化が始まっているのがわかる
図3 DNAとRNAのイメージ(特に、青い RNA からの信号の減少)から老化が始まっているのがわかる
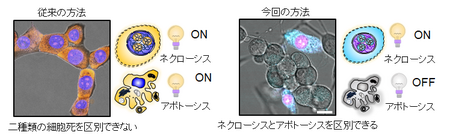
また、RNA/DNAの変化に基づく観察によって、細胞死の全段階(アポトーシス(7)、壊死(ネクローシス)(8)、ネクロプトーシス(9)、老化(10))を高精度で検出することが可能になりました。一例として、今回の手法では、生検体で壊死(ネクローシス)細胞を選択的に染色することができます。それによって、プログラムされた細胞死であるアポトーシスを起こしている細胞と、望まない偶発的な細胞死である壊死(ネクローシス)を起こしている細胞とをはっきりと見分けることができます(図4)
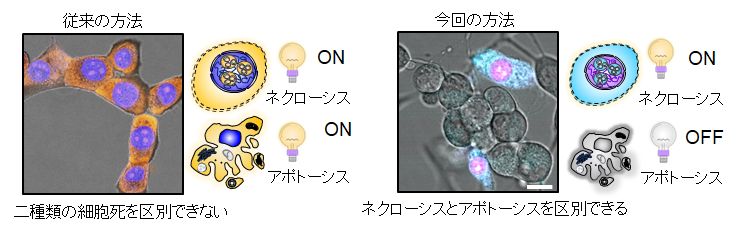 図4 プログラムされた細胞死(アポトーシス)と望まない偶発的な細胞死(ネクローシス)の区別が可能
図4 プログラムされた細胞死(アポトーシス)と望まない偶発的な細胞死(ネクローシス)の区別が可能
これらの知見は、単一細胞の状態遷移を可視化する戦略として、現在利用可能なあらゆるイメージングシステムの限界を超える方法になります。細胞の損傷や老化を超早期に発見することが可能となり、細胞毒性を最小限に抑えたイメージングワークフローを通して、生細胞の検査による疾病の発見やハイスループット創薬スクリーニングへの応用が期待されます。
今後の展開
研究チームは、色素プローブN-ヘテロアセン化合物の構造と機能の関係をさらに精査し、さまざまな細胞成分や生物学的プロセスとの相互作用について、より広い可能性を探求していきます。基礎的な観点から見ると、本研究は、分子レベルの精度で異なる生物学的プロセスを分析可能な多機能蛍光色素の開発において重要なマイルストーンとなります。ここで示したアイデアをもとに、さまざまな有用な色素プローブが開発され、生細胞の検査や、薬剤の検査を通して、ハイスループット創薬スクリーニングがなされることが期待されます。また、今後、この手法の実際の生物への応用も検証していきたいと考えています。疾患の早期発見や細胞ストレスのモニタリング、それらに基づく精密医療戦略を可能にする道筋を拓き、“未病(健康な状態と病気の間にある、健康から離れつつある状態)にあることが細胞を見ればわかる”技術の開発を目指します。
■掲載論文
|
題目 |
Visualizing the Chronicle of Multiple Cell Fates using a Near-IR Dual-RNA/DNA-Targeting Probe |
|
著者 |
Linawati Sutrisno,* Gary J. Richards, Jack D. Evans, Michio Matsumoto, Xianglan Li, Koichiro Uto, Jonathan P. Hill,* Masayasu Taki,* Shigehiro Yamaguchi,* Katsuhiko Ariga* |
|
雑誌 |
Science Advances |
|
DOI |
10.1126/sciadv.adz6633 |
|
掲載日 |
2025年10月23日 |
■用語解説
(1) 細胞運命
細胞がほかの細胞に分化したり、老化したり、死んでしまったりなど変化の行く末を一般的に示した表現。
(2) 細胞イメージングプローブ
細胞の中で特別な化学反応や相互作用によって光を発するなどの方法で細胞やその中の成分の位置をわかるようにする分子や物質
(3) 自家蛍光
細胞や組織が特定の光に曝露された際に、色素を添加することなく細胞が自然に示す発光。
(4) 蛍光色素プローブ
特定の生体分子に相互作用したり、反応したりすることで蛍光を発し、それを光らせることで可視化・検出することのできる色素分子
(5) N-ヘテロアセン色素
窒素原子を含むベンゼン環が連結した有機分子の一種。強い光吸収・発光特性を持つため、イメージングやエレクトロニクス分野で高く評価されている。分子の設計によって励起や発光の波長を変えることができ、大変有用である。
(6) 細胞毒性
画像観察中に強い光または長時間の光に曝露されることで生じる細胞損傷。
(7) アポトーシス
管理・調節された細胞の自然死、つまりプログラムされた細胞死のこと。
(8) 壊死(ネクローシス)
偶発的な細胞死、または事故的細胞死で、感染や損傷等の非生理的状態による細胞死のこと。
(9) ネクロプトーシス
ネクロプトーシスは制御された形態のネクローシスで、アポトーシスが阻害された場合に活性化される細胞の自己破壊のプロセス。
(10) 老化
細胞が分裂を停止し、恒久的な細胞周期の停止状態に入る過程。
|
NIMSとは? NIMS(ニムス)は、物質・材料科学の研究に特化した国立研究開発法人です。 世界を構成するさまざまな「物質」。そのなかで私たちの生活を支えているのが「材料」です。 その材料も、大きくは有機・高分子材料、無機材料に分類でき、無機材料はさらに金属材料とセラミックス材料とに分けられます。 石器時代から産業革命を経て現代まで、人類の発展はこの材料の進歩とともにありましたが、近年では、地球規模の環境や資源問題の解決手段のひとつとしても注目が高まっています。NIMSはその物質・材料お研究に特化した研究所として、「材料で、世界を変える」をテーマに、未来を拓く物質・材料の研究に日々取り組んでいます。
【NIMSを掴む参考ページ】 NIMSはこんな研究所 ! https://www.nims.go.jp/nims/introduction.html |
編集部からのお知らせ
新着情報
あわせて読みたい

自動車リサイクル促進センター